Васкулярный эндотелиальный фактор роста (VEGF165)
Изоформа VEGF165 была первым идентифицированным членом семейства васкулярных эндотелиальных факторов роста. VEGF165 является основным сосудистым эндотелиальным фактором роста в человеческих тканях. VEGF165 транскрибируется в виде 191 членного полипептида, но затем сигнальные 25 первых аминокислотных остатка специфически отщепляются протеиназой. Зрелый белок состоит из 165 аминокислотных остатка первые 115 участвуют в образовании цистеинового узла и ответственны за связывание с рецептором. С концевые 25 аминокислотных остатка не участвуют в рецепторном взаимодействии, а несут сайты аффиности к гепарину (N. Ferrara, 2010).
Биологически активной формой данного белка является гомодимер, каждых мономер имеет один сайт гликозилирования (Asn 75) с молекулярной массой 19165 Да, pI 7,429, образован семью β-складчатыми листами, и двумя α-спиралями, соединенных тремя дисульфидными мостиками (Muller et al., 1997).
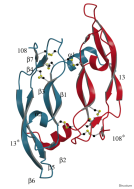
Рис. 3. Модель димера VEGF165 (Muller et al., 1997)
Необычная структура внутримолекулярных цистеиновых мостиков получила название мотив «Цистеиновый узел» представленна на рис 4.
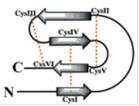
Рис. 4. схема фактора роста содержащего мотив «Цистеиновый узел» (Shalini Iyer and K. Ravi Acharya 2011)
При расщеплении VEGF165 плазмином образуются два ранее описанных домена: амино-терминальный рецептор связывающий домен (1-110 аминокислотных остатка) и С-концевой гепарин связывающий домен (C. Wiesmann et al., 1997; R.G. Keck et al., 1997).
Понимание биологических свойств сосудистого эндотелиального фактора роста и механизма рецептор опосредованного ангиогенеза открыли широкие возможности терапевтического применения VEGF, а также создание стратегий борьбы с онкологическими заболеваниями.