Сосудистый эндотелиальный фактор роста - А
VEGF-А является наиболее мощным и основным регулятором ангиогенеза и васкулогенеза. VEGF-А, высоко специфичный митоген для сосудистых эндотелиальных клеток, способствующий высвобождению белков из кровеносных сосудов, ассоциированных с опухолью. Делеции генов, кодирующих VEGF-А, приводят к серьезным дефектам и неправильному развитию сердечно-сосудистой системы. Гипоксия является главным активатором экспрессии VEGF-А и, как полагают, управляет ангиогенезом во время развития органов. С другой стороны, ограничение/уменьшение доставки VEGF-А к тканям приводит к задерживанию развития органов.
VEGF-А существует в восьми изоморфных формах: VEGF121, VEGF145, VEGF148, VEGF165, VEGF183, VEGF189, VEGF206, образуемых в результате альтернативного сплайсинга мРНК, которая состоит из 8-ми экзонов. Эти изоформы отличаются в способности связывать гепарин- и гепаран-сульфат.
VEGF-А экспрессируется in vivo в пространственно- временной связи с физиологическим ангиогенезом, а также и с опухолевым. Экспрессия VEGF-А стимулирует образование везикуло-вакуолярных органелл, которые служат каналом для переноса белков крови в опухоли.
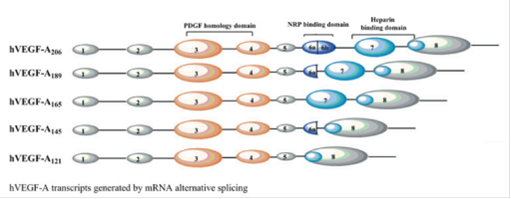
Рис. 1. Изоформы VEGF-А, образующиеся в результате альтернативного сплайсинга мРНК VEGF-А.
Показаны домен, гомологичный PDGF (PDGF homology domain) (оранжевый), гепарин-связывающий домен (heparin-binding domain) (светло синий) и NRP связывающий домен (NRP-binding domain) (синий) (Shalini Iyer and K. Ravi Acharya 2011).
Они формируют внесосудистый фибриновый гель, который стимулирует эндотелиальные и опухолевые клетки к пролиферации и миграции, а также помогает стромальным клеткам проникать в растущие опухоли. Взаимодействие лиганда с рецептором запускает сигнальный каскад, который в конечном итоге стимулирует рост эндотелиальных клеток сосуда, их выживание и пролиферацию (Bonnie et al., 2009).
При активации рецепторов VEGFR участвуют также «вспомогательные» белки FRS2, которые так же, как и в случае FGFR рецептора, фосфорилированные по тирозиновым и серин-треониновым остаткам, связывают адапторные белки Grb2 и Shp2 (тирозин-фосфатазу) и запускают внутриклеточную сигнальную последовательность PKC (протеин-киназа С), PI3K, Src и Crk (Matsumoto and Mugishima, 2006).
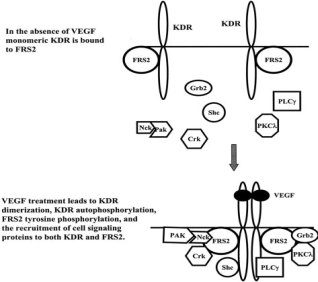
Рис. 2. Связывание VEGF с рецептором VEGFR, запуск сигнальной последовательности