Клонирование и секвенирование фракций 2'-F- пиримидинсодержащей РНК-библиотеки
Для проведения клонирования фракций I, II и III 2'-F-модифицированной РНК-библиотеки были использованы олигонуклеотиды-праймеры, комплементарные 3'- и 5'-константным участкам комбинаторной ДНК-библиотеки и содержащие сайты рестрикции эндонуклеаз рестрикции HindIII и BamHI, соответственно (рис. 18).
'-праймер HindIII
'-CCGAAGCTTGAAATAATACGACTCACTATAGGGAGGACGATGC GG-3' кодирующая цепь дцДНК-библиотеки
'-CCC TCC TGCTACG CC<40N>GTC TGC TG AGC GCG CT-5'
транскрибируемая цепь дцДНК-библиотеки
'-GGGAGGACGATGCGG<40N>CAG ACG ACT CGCGCGA-3'
'-GTC TGC TGAGCC GGCTCCTAGGGCG-5'
'-праймер BamHI
Рис. 18. Система комбинаторной дцДНК-библиотеки с 5'-праймером HindIII и 3'-праймером BamHI. Цветом выделены: … - сайт рестрикции HindIII, … - сайт рестрикции BamHI.
Фракции I, II и III 2'-F-модифицированной РНК-библиотеки переводили в дцДНК-форму методом ОТ-ПЦР высокой точности с использованием 3'-праймера BamHI и 5'-праймера HindIII. Полученную дцДНК-библиотеку фракций I, II и III клонировали в векторе pUC18 по сайтам эндонуклеаз рестрикции BamHI и HindIII (рис. 19).
5'-G TAA AAC GAC GGC CAG TGC CAA GCT TGC ATG CCT GCA GGT CGA CTC TAG AGG ATC CCC GGG TAC CGA GCT CGA ATT CGT AAT CAT GGT CAT AGC TGT TTC CTG - 3'
Рис. 19. Полилинкерный участок (ПЛУ) вектора pUC18. Цветами выделены: … - сайт рестрикции эндонуклеазы HindIII, … - сайт рестрикции эндонуклеазы BamHI, … - сайт рестрикции эндонуклеазы PstI. Жирным шрифтом отмечен ПЛУ вектора pUC18.
Предварительно была проведена проверка рестриктазной активности отдельно каждой эндонуклеазы рестрикции. Для этого 0.2 мкг pUC18 инкубировали с 0.2 е.а. BamHI или HindIII при 37°С в течение 5 мин с последующим инактивированием ферментов при 80°С в течение 10 мин. Продукт реакции гидролиза анализировали электрофорезом в 1%-ном агарозном геле (рис. 20).
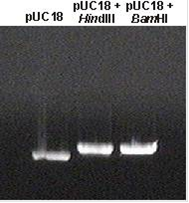
Рис. 20. Электофоретический анализ реакционных смесей гидролиза вектора pUC18 рестриктазами BamHI и HindIII в 1%-ном агарозном геле. В качестве контроля использован вектор pUC18 (0.2 мкг). Визуализацию полос олигонуклеотидов проводили с помощью системы гель-документации “Gel imager 2” (“НПФ” Биоклон).
Из полученных данных можно сделать вывод, что 1 е. а. рестриктазы BamHI или HindIII достаточно, чтобы за 5 мин перевести в линейную форму 1 мкг pUC18. С учетом этого соотношения была проведена реакция рестрикции ДНК вектора pUC18 и фракций I, II и III эндонуклеазами рестрикции BamHI и HindIII с последующим лигированием полученных ДНК с “липкими” концами в соотношении 1:20. В полученную реакционную смесь добавляли эндонуклеазу рестрикции PstI для расщепления по ПЛУ молекул вектора pUC18, не содержащих вставок дцДНК фракций. Полученную реакционную смесь, содержащую плазмидную ДНК с вставкой дцДНК фракций I, II или III, использовали для трансформации компетентных клеток E.coli штамма DH5α (п. 2.3.13.).
Для отбора колоний E.coli, содержащих плазмидную ДНК, был использован метод фенотипической селекции. Поскольку вектор pUC18 содержит ген устойчивости к ампициллину, полученную после трансформации суспензию клеток E.coli высевали на чашку Петри с селективным LB-агаром, содержащим 100 мкг/мл ампициллина. В качестве контроля на две других чашки Петри с селективным LB-агаром высевали клетки E.coli, трансформированные вектором pUC18, и исходные компетентные клетки E.coli. Все чашки Петри инкубировали в суховоздушном термостате при 37°С в течение 16-18 ч. В результате чашка Петри с нетрансформированными клетками E.coli была пуста; чашка Петри с клетками E.coli, трансформированными вектором pUC18, содержала множество колоний разной величины и окраски - от белой до синей; чашка Петри с клетками E.coli, трансформированными плазмидной ДНК с вставкой дцДНК фракций I, II или III, содержала несколько колоний разного размера белой или светло-голубой окраски. Таким образом было показано, что трансформация клеток E.coli проходит эффективно, а используемого количества антибиотика достаточно для проведения фенотипической селекции.
Для разделения разных колоний, трансформированных E.coli, полученные колонии высевали на чашку Петри с селективным LB-агаром (по 4 колонии на чашку). В качестве контроля на новую чашку Петри также переносили одну колонию E.coli, трансформированную вектором pUC18. Для выявления колоний E.coli, содержащих плазмидную ДНК с вставкой экзогенной ДНК, обычно используют метод бело-голубой селекции [173]. Полилинкерный участок вектора pUC18 расположен в гене lacZ, кодирующем β-галактозидазу - фермент класса гидролаз, катализирующий расщепление лактозы на галактозу и глюкозу. β-Галактозидаза расщепляет 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (X-Gal) на галактозу и 5-бром-4-хлорo-3-гидроксииндол, который в присутствии IPTG окисляется до 5,5'-дибром-4,4'-дихлор-индиго (нерастворимый осадок синего цвета). При встраивании экзогенной ДНК в вектор pUC18 по ПЛУ сбивается рамка считывания β-галактозидазы, и фермент не вырабатывается. Таким образом, колонии, содержащие вектор pUC18, при выращивании на селективном LB-агаре с добавлением X-Gal и IPTG приобретают синий цвет, а колонии, содержащие вектор pUC18 с вставкой экзогенной ДНК по ПЛУ, остаются белыми.