Оптимизирование и апробация методики отбора аптамеров к поликлональным аутоантителам
Один раунд отбора аптамеров состоит из нескольких стадий (п.1.1.) (рис. 2): образование комплекса мишени и комбинаторной библиотеки; отделение комплексов от несвязавшихся молекул; разрушение комплексов мишени и комбинаторной библиотеки; амплификация связавшихся с мишенью молекул комбинаторной библиотеки. Поэтому для оптимизирования методики отбора 2'-F-модифицированных РНК-аптамеров необходимо было решить следующие задачи:
1) апробировать все реакции стадии амплификации 2'-F-модифицированной РНК-библиотеки;
2) выбрать и апробировать метод разделения комплексов молекул-мишеней с 2'-F-модифицированной РНК-библиотекой и несвязавшихся молекул.
Стадия амплификации 2'-F-модифицированной РНК-библиотеки включает несколько реакций: обратную транскрипцию, ПЦР, транскрипцию in vitro.
Для решения первой задачи была проведена реакция обратной транскрипции 2'-F-модифицированной РНК-библиотеки в соответствии с протоколом [54] с использованием обратной транскриптазы AMV. Полученную кДНК далее использовали в ПЦР. Одним из варьируемых параметров ПЦР является температура отжига праймеров с кДНК. Обычно температура отжига праймеров на 4-5 градусов ниже их температуры плавления с кДНК [171]. Чем ниже температура отжига праймеров, тем больше вероятность образования неспецифичного продукта. При помощи программы OligoAnalyzer 3.1 [172] нами были рассчитаны температуры плавления праймеров с кДНК. Они составляют 72.7ºC и 68.5ºС для дуплексов кДНК c 5'-праймером и 3'-праймером, соответственно. Для подбора оптимального температурного режима нами была проведена ПЦР в градиенте температур отжига праймеров от 43.1ºС до 63.2ºС. Пробы анализировали гель-электрофорезом в 12%-ном ПААГ в денатурирующих условиях с последующим окрашиванием геля раствором красителя “Stains-All” (рис. 13). В качестве контроля использовали реакционную смесь репликации ДНК-библиотеки фрагментом Кленова с использованием 5'-праймера dm 28 long.
контроль без матрицы реакционная смесь ПЦР
с dm 28 dm 28 long с dm 28 dm 28 long дцДНКконтр
60 55 49 45 43 60 55 49 45 43 63 60 55 49 45 43 63 60 55 49 45 43
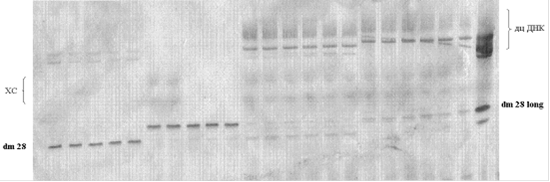
Рис. 13. Электрофоретический анализ реакционных смесей ПЦР в градиенте температур отжига праймеров (слева направо): 63.2ºС (63), 60.1ºС (60), 55.1ºС (55), 49.7ºС (49), 45.3ºС (45), 43.1ºС (43). В качестве контроля использованы реакционные смеси ПЦР, не содержащие матрицу, и реакционная смесь репликации ДНК-библиотеки с использованием фрагмента Кленова и 5'-праймера dm 28 long. Электрофорез был проведен в 12%-ном ПААГ в денатурирующих условиях.
Количество ПЦР-продукта в реакционных смесях практически не зависело от температуры отжига праймеров и составило 42 пмоль и 50 пмоль на 100 мкл реакционной смеси с использованием 5'-праймеров dm 28 и dm 28 long, соответственно. Поэтому было решено проводить отжиг праймеров при 63ºС для максимальной специфичности связывания праймеров с ДНК-матрицей. После очистки было выделено 247,8 пмоль дцДНК 1 и 300 пмоль дцДНК 2. С использованием полученных дцДНК были проведены реакции транскрипции in vitro с использованием 2'-F-модифицированных пиримидинтрифосфатов отдельно для каждой дцДНК-библиотеки. После очистки количество продукта составило 308 пмоль и 866 пмоль 2'-F-РНК с дцДНК 1 и дцДНК 2, соответственно. На основании полученных данных был сделан вывод, что эффективность транскрипции in vitro с 2'-F-модифицированными пиримидинтрифосфатами повышается при использовании в качестве матрицы удлиненной дцДНК-библиотеки (дцДНК 2). Поэтому для амплификации 2'-F-модифицированной РНК-библиотеки мы использовали 5'-праймер dm 28 long.
Таким образом, были оптимизированы и апробированы все реакции стадии амплификации 2'-F-модифицированной РНК-библиотеки, что позволило нам получить 2'-F-модифицированную РНК-библиотеку в требуемых количествах и перейти к решению следующей задачи.