Химико-ферментативный синтез 2'-F-модифицированной РНК-библиотеки
Как было ранее сказано в обзоре литературы, комбинаторную 2'-F-модифицированную РНК-библиотеку получают химико-ферментативным путем, состоящим из 3-х этапов:
) химический синтез комбинаторной оцДНК-библиотеки;
) репликация оцДНК-библиотеки с использованием фрагмента Кленова ДНК-полимеразы E.coli и 5'-праймера для амплификации, содержащего последовательность промотора Т7 РНК-полимеразы;
) транскрипция in vitro дцДНК-библиотеки с использованием 2'-F-UTP и 2'-F-CTP.
В данной работе в качестве исходной олигонуклеотидной библиотеки была выбрана, по аналогии с литературными данными [168], оцДНК-библиотека с рандомизированным районом длиной 40 нт и константными 5'- и 3'-участками длиной 16 нт и 15 нт, соответственно (рис. 8). В качестве праймеров для амплификации комбинаторной библиотеки были выбраны 3'-праймер dm 29 (16 нт), комплементарный 5'-фиксированному району оцДНК-библиотеки, и 5'-праймер dm 28 (32 нт), комплементарный 3'-фиксированному району оцДНК-библиотеки и содержащий промоторную последовательность для Т7 РНК-полимеразы (помечена желтым цветом). Протяженные природные дцДНК-матрицы транскрибируются РНК-полимеразами более эффективно, нежели короткие синтетические дцДНК. Считается, что это связано с наличием предпромоторного участка, облегчающего образование комплекса фермента с матрицей. Для того, чтобы узнать, как влияет удлинение 5'-участка дцДНК-библиотеки на количество получаемого транскрипта, был использован удлиненный 5'-праймер dm 28 long (37 нт), дополнительно содержащий 5 нуклеотидов перед промоторной последовательностью (рис. 8).
5'-праймер dm 28
'-TAATACGACTCACTATAGGG AGG ACG ATG CGG-3' оцДНК-библиотека
'-CCC TCC TGC TAC GCC<40N>GTC TGC TG AGC GCG CT-5'
5'-TCG CGC GA GTCGTCTG-3'
'-праймер dm 29
'-праймер dm 28 long
'-GAAATTAATACGACTCACTATAG GGA GGA CGA TGC GG - 3' оцДНК-библиотека
'- C CCT CCT GCT ACG CC <40N>G TCT GCT GAG CGC GCT - 5'
'-TC GCG CGA GTCGTCTG-3'
3'-праймер dm 29
Рис. 8. Система комбинаторной оцДНК-библиотеки с 5'- и 3'-праймерами.
На первом этапе работы была синтезирована комбинаторная оцДНК-библиотека. Для этого был использован автоматический твердофазный фосфитамидный метод (рис. 9). Синтез вели на автоматическом синтезаторе ДНК/РНК ASM-800 (“Биоссет”, Россия) в масштабе 0.4 мкмоль согласно протоколу, представленному в табл. 3 (п. 2.3.1.). Цикл присоединения одного нуклеотидного звена занимал вместе с промывками 7-10 мин.
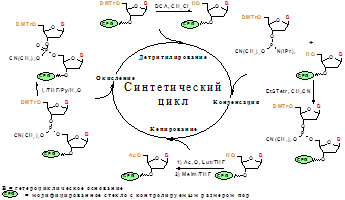
Рис. 9. Схема синтетического цикла фосфитамидного синтеза олигодезоксирибонуклеотидов.
В качестве полимерного носителя использовали модифицированное стекло с контролируемым размером пор CPG-500 c присоединенным 5'-O-диметокситритил-N4-ацетилдезоксирибоцитидином (емкость по первому присоединенному звену составляла 30-35 мкмоль/г). В качестве мономерных синтонов были использованы коммерчески доступные 5',N-защищенные дезоксирибонуклеозид-3'-фосфитамиды с лабильными защитными группами по гетероциклическим основаниям: ацетильной для цитидина, бензоильной для аденозина и изобутирильной для гуанозина.
Как видно из рис. 9, синтетический цикл состоит из стадий детритилирования, конденсации, кэпирования и окисления.
Стадия детритилирования необходима для удаления диметокситритильной защитной группы с 5'-гидроксила растущей олигонуклеотидной цепи. Для этих целей была использована обработка 3%-ным раствором дихлоруксусной кислоты в дихлорметане в течение двух минут.
Наиболее важной стадией синтетического цикла является стадия конденсации. В качестве активирующего реагента обычно используют тетразол или его производные. Показано, что использование 5-этилтио-1H-тетразола вместо тетразола позволяет сократить время конденсации в несколько раз [169]. Концентрация для дезоксирибофосфитамидов в случае синтеза константных участков составляла 0.05 М, а в случае синтеза рандомизированного района готовили “общий” раствор четырех дезоксирибофосфитамидов в абс. CH3CN с концентрациями 0.058 М dА-CE, 0.058 М dC-CE, 0.070 М dG-CE и 0.056 М dТ-CE.
При синтезе целевого олигонуклеотида образуются побочные продукты - олигомеры с длиной n-1, n-2 и т.д., что происходит из-за наличия непрореагировавших 5’-гидроксильных групп, которые необходимо блокировать (“кэпировать”) после каждой стадии конденсации. Для “кэпирования” нами были использованы последовательно 16% N-MeIm в THF и Ac2O:2,6-лутидин:THF (1:1:8), что обеспечивает “кэпирование” с эффективностью 95-98% [170].
Заключительной стадией синтетического цикла является стадия окисления, в ходе которой происходит превращение фосфиттриэфирных межнуклеозидных связей в фосфотриэфирные. В случае неполного окисления межнуклеозидный фосфиттриэфир подвергается расщеплению в кислотных условиях при удалении диметокситритильной группы, что приводит к падению выхода целевого олигомера. Для окисления был использован 0.02 М I2 в смеси THF/Py/H2O (90:1:9). После проведения необходимого числа синтетических циклов и удаления 5’-концевой диметокситритильной группы получали защищенную полимерсвязанную оцДНК-библиотеку. Защищенные полимерсвязанные 3'-праймер dm 29, 5'-праймер dm 28, 5'-праймер dm 28 long и оцДНК-библиотеку деблокировали (п. 2.3.2.) с последующим выделением препаративным гель-электрофорезом (п. 2.3.3.).