Анализ структуры аптамеров
Для определения нуклеотидных последовательностей аптамеров полученную в последнем раунде SELEX обогащенную библиотеку в дцДНК-форме клонируют и секвенируют [3, 4]. Для этого обогащенную дцДНК-библиотеку амплифицируют с использованием праймеров, содержащих сайты рестрикции соответствующих эндонуклеаз. Полученную дцДНК и вектор, содержащий в полилинкерном участке сайты рестрикции соответствующих эндонуклеаз рестрикции, инкубируют с рестриктазами для образования “липких” концов. Далее комбинаторную библиотеку и вектор “сшивают” действием Т4 ДНК-лигазы. Полученную плазмидную ДНК используют для трансформации компетентных клеток E.coli. После наращивания клеточной массы полученных трансформированных колоний E.coli плазмидную ДНК выделяют и секвенируют [3, 4, 16]. Обычно секвенируют порядка 30 -100 клонов [3, 4]. Полученные нуклеотидные последовательности анализируют с использованием таких программых пакетов, как ClustulW [89] или MEME [90], и выявляют их гомологичные участки [3, 91]. Клоны, обладающие масимально схожими нуклеотидными последовательностями, объединяют в группы, проводят повторный анализ нуклеотидных последовательностей внутри группы и выявляют консервативные участки. Именно консервативные участки аптамеров отвечают за взаимодействие с мишенью. Ранее было показано, что главную роль в связывании аптамера с мишенью играют неспаренные участки олигонуклеотида, а часть аптамера, обладающая стабильной вторичной структурой, служит для поддержания правильного расположения участков, узнающих мишень [9, 79]. Поэтому для всех полученных клонов проводят компьютерное моделирование вторичной структуры, обычно используя программный пакет mfold [92]. В состав вторичной структуры олигонуклеотидов входят так называемые шпилечные структуры (структура “стебель-петля”) [13, 93], “псевдоузлы” [55, 93], в случае G-богатых последовательностей - “G-квадруплексы” [33, 94, 95] (рис. 7)
При этом для ДНК-аптамеров характерными являются G-квадруплексы различных типов [95], а для РНК-аптамеров - G-квадруплексы [96], псевдоузлы [93] и структуры типа стебель-петля [49].

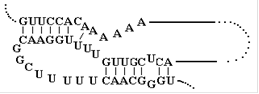
“Стебель-петля” “Псевдоузел”
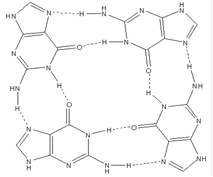
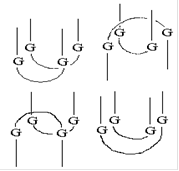
“G-квадруплекс”
Рис. 7 Типы пространственной структуры олигонуклеотидов: “стебель-петля”, “псевдоузел”, “G-квадруплекс”.
Для каждого полученного клона измеряют константу диссоциации его комплекса с мишенью, т.е. определяют его сродство к мишени. Для определения Kd часто применяют EMSA (анализ изменения электрофоретической подвижности) [45, 93] или адсорбцию на нитроцеллюлозных фильтрах [6, 55] в случае радиоактивно меченной комбинаторной библиотеки, а также поверхностный плазмонный резонанс (SPR) [35, 49] и измерение флуоресценции с использованием флуоресцентных зондов Beacon [41] для комбинаторной библиотеки без радиоактивной метки. Обычно константы диссоциации комплексов белок-аптамер лежат в пределах 10-9 - 10-11 M [9, 35], что является показателем большого сродства аптамера к молекуле-мишени. Также исследуют влияние полученных клонов на молекулу-мишень. Большинство аптамеров являются ингибиторами своих мишеней [35, 40], но существуют также аптамеры-активаторы [97, 98].
Из полученных клонов выбирают те, которые обладают необходимыми свойствами (например, аптамеры-ингибиторы), а также наибольшими сродством и специфичностью к молекуле-мишени и дальше работают только с ними. Для того чтобы определить мишень-связывающие участки аптамера, на комплекс аптамер-мишень действуют нуклеазами и химическими реагентами, специфически расщепляющими одноцепочечные и двуцепочечные участки олигонуклеотидов. Такой анализ структуры аптамера называют футпринтингом [3, 35, 93], а полученную белок-связывающую часть аптамера - “укороченным” аптамером. “Укороченные” аптамеры обычно обладают практически таким же [55], а иногда даже большим сродством к молекуле-мишени [36]. Получение “укороченного” аптамера позволяет также в дальнейшем снизить затраты на его синтез. Введение точечных мутаций в последовательность “укороченного” аптамера позволяет выявить влияние на взаимодействие с мишенью отдельно взятого нуклеотида [36]. Завершающим этапом анализа структуры аптамера является получение трехмерной структуры его комплекса с белком-мишенью. Для этого применяют метод ковалентных сшивок [43], ЯМР [99], кристаллографию и дифракцию рентгеновских лучей [3, 100].