Метод SELEX
Отбору аптамеров in vitro к различным молекулам-мишеням посвящено множество обзоров [2, 3, 8, 30]. Отбор аптамеров проводят из комбинаторных библиотек олигонуклеотидов. Перед началом селекции проводят дизайн комбинаторной библиотеки, представляющей собой рандомизированный район, фланкированный двумя участками с фиксированной последовательностью (рис. 1).
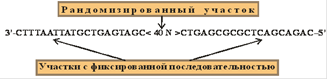
Рис. 1. Комбинаторная библиотека олигонуклеотидов.
При дизайне комбинаторной библиотеки учитывают такие факторы, как тип библиотеки, длина рандомизированного участка, свойства константных районов. Рандомизированная часть комбинаторной библиотеки отвечает за формирование разнообразных пространственных структур. Константные участки необходимы для амплификации комбинаторной библиотеки. Чем больше длина рандомизированного района, тем больше число разнообразных пространственных структур, которые формирует библиотека. Однако рандомизированный район редко превышает 100 нт. Во-первых, при химическом синтезе комбинаторной библиотеки, чем больше ее длина, тем меньше конечный выход. Во-вторых, на первый раунд отбора берут от сотен пмолей до нескольких нмолей комбинаторной библиотеки, что составляет примерно от 1014 до 1016 разнообразных молекул. Это колчество молекул соответствует комбинаторной библиотеке с рандомизированным районом 25 нт (425 = 1015). Поэтому в случае протяженных комбинаторных библиотек в отборе принимает участие то же количество разнообразных молекул, что и в случае коротких комбинаторных библиотек. В последние годы наиболее часто используют комбинаторные библиотеки с рандомизированным районом длиной 30 - 40 нт.
Полученную химическим синтезом комбинаторную библиотеку инкубируют с молекулой-мишенью (рис. 2). Образовавшиеся комплексы отделяют от несвязавшихся молекул, разрушают и амплифицируют связавшиеся с мишенью олигонуклеотиды, получая обогащенную библиотеку.
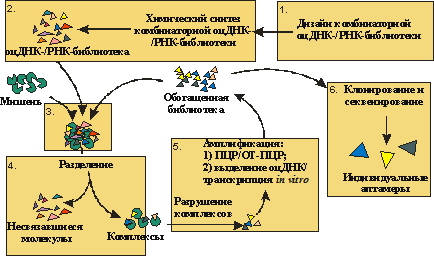
Рис. 2. Общая схема получения аптамеров. Каждый раунд отбора состоит из 1. дизайн комбинаторной оцДНК- или РНК-библиотеки; 2. химический синтез комбинаторной стадий: оцДНК- или РНК-библиотеки; 3. инкубирование комбинаторной библиотеки олигонуклеотидов с молекулой-мишенью; 4. отделение комплексов комбинаторной библиотеки с мишенью от несвязавшихся молекул; 5. разрушение комплексов комбинаторной библиотеки с мишенью и амплификация связавшихся с мишенью олигорибонуклеотидов; 6. клонирование и секвенирование обогащенной библиотеки после последнего раунда отбора, определение нуклеотидных последовательностей индивидуальных аптамеров.
Комбинаторная библиотека проходит несколько раундов отбора до тех пор, пока сродство обогащенной библиотеки к молекуле-мишени не достигнет максимума. Обычно для этого требуется 4 - 20 раундов SELEX, что занимает от нескольких недель до нескольких месяцев. Применение автоматических методов отбора аптамеров существенно ускоряет этот процесс и позволяет проводить до 10 раундов отбора в день [31].
Обогащенную дцДНК-библиотеку, полученную в последнем раунде SELEX, клонируют и секвенируют. Последовательности индивидуальных клонов анализируют и определяют оптимальную аптамерную последовательность (п. 1.4.).
С тех пор, как впервые был предложен метод SELEX для отбора аптамеров [4, 5], создано и апробировано более десятка его различных модификаций. В табл. 1 приведены виды SELEX, использующиеся при отборе аптамеров к белковым молекулам-мишеням.
Таблица 1. Виды отбора НК-аптамеров к белковым мишеням.
|
Название метода отбора |
Особенности метода |
Ссылка |
|
Counter -SELEX |
В ходе отбора комбинаторная библиотека поочередно инкубируется с белком-мишенью и родственным ему белком. Амплифицируются олигонуклеотиды, связывающиеся только с молекулой-мишенью. |
[32-34] |
|
Toggle-SELEX |
В ходе отбора комбинаторная библиотека поочередно инкубируется с несколькими молекулами-мишенями. Амплифицируются олигонуклеотиды, связывающиеся со всеми молекулами-мишенями. |
[35] |
|
SELEX with structurally constrained libraries |
В отборе используется комбинаторная библиотека, последовательность фиксированных участков которой формирует определенную вторичную структуру. Такой же вторичной структурой будет обладать полученный аптамер. |
[5, 36] |
|
Genomic SELEX или cDNA-SELEX |
В отборе используется комбинаторная библиотека, рандомизированный район которой заменен на геномную последовательность. В качестве мишени используется белок того же организма, которому принадлежит геномная последовательность. Метод позволяет выявить в геномной последовательности сайты связывания белков. |
[37] |
|
Tailored SELEX |
В отборе используется комбинаторная библиотека с короткими константными участками (10 нт). Для амплификации связавшихся с мишенью олигонуклеотидов проводится реакция лигирования участков с фиксированной последовательностью к библиотеке. Метод используется для получения коротких аптамеров. |
[38, 39] |
|
Blended SELEX |
В отборе используется комбинаторная библиотека, включающая какой-либо лиганд ненуклеотидной природы. Метод позволяет придать аптамеру дополнительные свойства, помимо мишень-связывающих. |
[40] |
|
Covalent SELEX или Cross-linking SELEX |
В отборе используется комбинаторная библиотека, которая содержит активные группы, способные ковалентно связывать молекулу-мишень. Таким же свойством будет обладать полученный аптамер. |
[41, 42] |
|
TECS-SELEX (target expressed on cell surface-SELEX) |
В качестве мишени используется экспрессирующаяся на клеточной поверхности рекомбинантная или природная молекула-мишень. |
[43] |
|
EMSA-SELEX (еlectrophoretic mobility shift assays-SELEX) |
В ходе отбора для разделения комплексов олигонуклеотидов с мишенью и несвязавшихся молекул используют гель-электрофорез. |
[17, 44, 45] |
|
CE-SELEX (capillary electrophoresis-SELEX) |
В ходе отбора для разделения комплексов олигонуклеотидов с мишенью и несвязавшихся молекул используют капиллярный электрофорез. |
[13, 46] |
|
FluMag-SELEX |
В ходе отбора мишень иммобилизуют на магнитных шариках. Для разделения комплексов олигонуклеотидов с мишенью и несвязавшихся молекул применяют магнитное поле. |
[36, 47] |